Chemia
18.06.2020
Temat: Wzory i nazwy wodorotlenków. Wodorotlenek sodu, potasu, wapnia.
19.06.2020
Temat: Wodorotlenki a zasady. Dysocjacja jonowa zasad.
Odpowiedz na pytania:
- Co to są zasady?
- Podaj przykład dysocjacji jonowej zasad.
- Korzystając z tabeli rozpuszczalności wodorotlenków i soli , podaj przykłady wodorotlenków które są zasadami ( 3 przykłady)
- Korzystając z tabeli rozpuszczalności wodorotlenków i soli , podaj przykłady wodorotlenków nierozpuszczalnych w wodzie ( 3 przykłady)
05.06.2020
Temat : Stężenie procentowe roztworu.
Odpowiedz na pytania korzystając z podręcznika str. 184-185
- Co to jest stężenie procentowe roztworu?
- Jak obliczyć stężenie procentowe ze wzoru?
- Jak obliczyć masę roztworu?
- Oblicz zadania:
- W 200g roztworu znajduje się 6 g substancji rozpuszczonej. Oblicz stężenie procentowe roztworu.
Dane: Szukane:
mr=??????????. Cp= ?????????????
ms= ?????????
- W 100 g roztworu znajduje się 3 g substancji rozpuszczonej. Oblicz stężenie procentowe roztworu.
Dane: Szukane:
mr =????????. Cp= ??????????..
ms= ????????
04.06.2020
Temat: Rodzaje roztworów. Rozpuszczalność substancji w wodzie.
Odpowiedz na pytania korzystając z podręcznika str. 170-181
- Co to jest roztwór?
- Czym roztwór nasycony różni się od roztworu nienasyconego?
- Czym roztwór stężony różni się od roztworu rozcieńczonego?
- Jak możemy podzielić wszystkie mieszaniny?
- Od czego zależy rozpuszczalność substancji stałych w wodzie?
- Od czego zależy szybkość rozpuszczania substancji stałych w wodzie?
28.05.2020
Temat: Woda i właściwości i rola w przyrodzie.
Proszę wykonać plakat dotyczący tematu. Proszę wesprzeć się informacjami zawartymi w podręczniku str.160-164. Można oczywiście korzystać także z innych źródeł informacji.
Oceniana będzie pomysłowość, kreatywność i zaangażowanie .
28.05.2020
Temat: Woda i właściwości i rola w przyrodzie.
Proszę wykonać plakat dotyczący tematu. Proszę wesprzeć się informacjami zawartymi w podręczniku str.160-164. Można oczywiście korzystać także z innych źródeł informacji.
Oceniana będzie pomysłowość, kreatywność i zaangażowanie .
TEMATY I KARTY PRACY 21-22.05.
14.05.2020
Temat: Powtórzenia wiadomości ? ?Wewnętrzna budowa materii i układ okresowy pierwiastków?
1. Podaj skład atomu:
- ………………………………..
- ……………………………….
……………………………….
2. Zaznacz elementy atomu na rysunku:
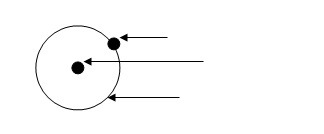
3. Umieć odróżnić atom od cząsteczki
Atom jest najmniejszą częścią pierwiastka chemicznego/największą częścią pierwiastka chemicznego. Pierwiastek jest substancją zbudowaną z jednakowych atomów/ różnych atomów. Atomy mogą występować pojedynczo/ nie mogą występować pojedynczo.
Na przykład:
Model: zapis chemiczny : czytamy:
Połączone atomy tego samego pierwiastka/ różnych pierwiastków tworzą cząsteczkę pierwiastka.
Na przykład:
Model: zapis chemiczny: czytamy:
Połączone atomy różnych pierwiastków/takich samych pierwiastków tworzą cząsteczkę związku chemicznego.
4. Odczytaj i zapisz gdzie występuje atom a gdzie cząsteczka:
- H2 – …………………………………………….. – H2O – ……………………………………….
- O2 – …………………………………………… – 2 H2O – …………………………………….
- 2 H – …………………………………………… – 3 O2 – ……………………………………….
- 2 O – …………………………………………… – 2 H2 – …………………………………………..
5. Narysuj modele atomów i cząsteczek podanych w zadaniu nr 4:
Modele atomów: Modele cząsteczek:
…………………………………………………………………………………………………………..
……………………………………………………………………………………………………………
…………………………………………………………………………………………………………….
………………………………………………………………………………………………………………..
5. Podaj liczbę protonów, elektronów i neutronów w atomie pierwiastka gdy dana jest liczba atomowa i masowa,:

6. Odczytaj z układu okresowego liczbę atomową i masę atomową. Czy pierwiastek jest metalem?
Tlen O – liczba atomowa (Z) = ………………………………………
Masa atomowa (u) = …………………………………………
Nr grupy – ……………………………………….
Nr okresu – ………………………………………….
Metal/niemetal ……………………………………….
Magnez Mg liczba atomowa (Z) = ………………………………………
Masa atomowa (u) = …………………………………………
Nr grupy – ……………………………………….
Nr okresu – ………………………………………….
Metal/niemetal ……………………………………………..
7. Co to są izotopy?
Izotopy są to :
- odmiany tego samego pierwiastka różniące się liczbą masową (A)
- odmiany tego samego pierwiastka różniące się liczbą atomową (Z)
Podaj izotopy wodoru:
……………………………………………………………………………
8. Znać zastosowanie izotopów promieniotwórczych. Dlaczego promieniotwórczość jest szkodliwa? ( podręcznik)
9. Wiedząc że, wartościowość = liczbie wiązań, a numer grupy głównej układu okresowego mówi nam jaka jest wartościowość, zaznacz ilość wiązań obok symboli pierwiastków za pomocą cyfr rzymskich i kresek

10. Na podstawie wzoru chemicznego ( sumarycznego) napisz wzór kreskowy ( strukturalny)
MgO ( tlenek magnezu)
FeO ( tlenek żelaza)
H2O ( cząsteczka wody)
11. Zaznacz prawidłową odpowiedź wiedząc, że lewa strona związku musi się równać prawej:
– zwór tlenku żelaza (III) ma postać :
- FeO
- Fe2O
- Fe2O2
- Fe2O3
12. Umieć obliczać masy cząsteczkowe :
O2 jest to jedna cząsteczka tlenu złożona z dwóch atomów tlenu, czyli masę cząsteczkową obliczamy następująco:
O2 = ……………………………………………………………………………….
H2 = …………………………………………………………………………………
H2O = …………………………………………………………………………….
07.05.2020
Temat: Prawo stałości składu związku chemicznego.
Podręcznik str. 137-141
1.Jak brzmi prawo stałości składu związku chemicznego.
2. Oblicz stosunek masowy
a) tlenku sodu Na2O
b) tlenku węgla (IV) CO2
c) bromku wapnia CaBr2
08.05.2020
Temat: Prawo zachowania masy.
Podręcznik str. 148- 150
- Jak brzmi prawo zachowania masy?
- Oblicz masę produktu reakcji chemicznej:
- Spalono 18g węgla w 48 g tlenu. Oblicz ile gramów tlenku węgla (IV) powstało w tej reakcji
Dane: Szukane:
- Oblicz ile gramów magnezu uległo spaleniu w 48g tlenu, jeśli otrzymano 120 g tlenku magnezu
Dane: Szukane
- W wyniku spalenia 12,7g miedzi w tlenie otrzymano 15,9g tlenku miedzi (II) Cu0. Oblicz ile gramów tlenu wzięło udział w tej reakcji chemicznej
Dane: Szukane:
24.04.2020
30.04.2020
Temat: Rodzaje wiązań chemicznych.
Proszę przeczytać uważnie przesłane treści. Na lekcji w piątek będziemy omawiać różnice pomiędzy wiązaniami chemicznymi
- Atomy pierwiastków łączą się ze sobą tworząc cząsteczkę pierwiastka lub cząsteczkę związku chemicznego.
- Atomy mogą łączyć się ze sobą za pomocą:
- Wiązania kowalencyjnego ( spolaryzowanego i niespolaryzowanego)
- Wiązania jonowego

- Wiązanie kowalencyjne ? polega na uwspólnianiu elektronów walencyjnych ( czyli tych na ostatniej powłoce elektronowej) łączących się atomów. Atomy łączą się dążąc do tego , aby na ostatniej powłoce miały 2 lub 8 elektronów.
Wodór znajduje się w 1 grupie układu okresowego, więc każdy atom ma 1 elektron walencyjny. Aby utworzyć cząsteczkę , atomy wodoru muszą zbliżyć się do siebie, tak aby ich elektrony walencyjne utworzyły wspólną parę.
H . + H . ———> H. . H
Wiązanie kowalencyjne pomiędzy atomami wodoru :
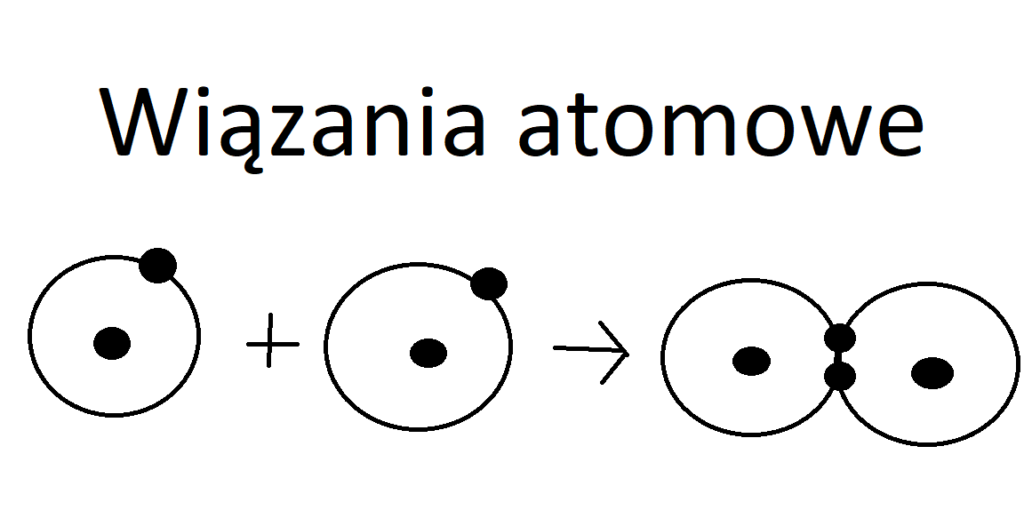
Wiązanie między atomami wodoru tworzą dwa elektrony, czyli jedna para elektronowa, jest to wiązanie pojedyncze.
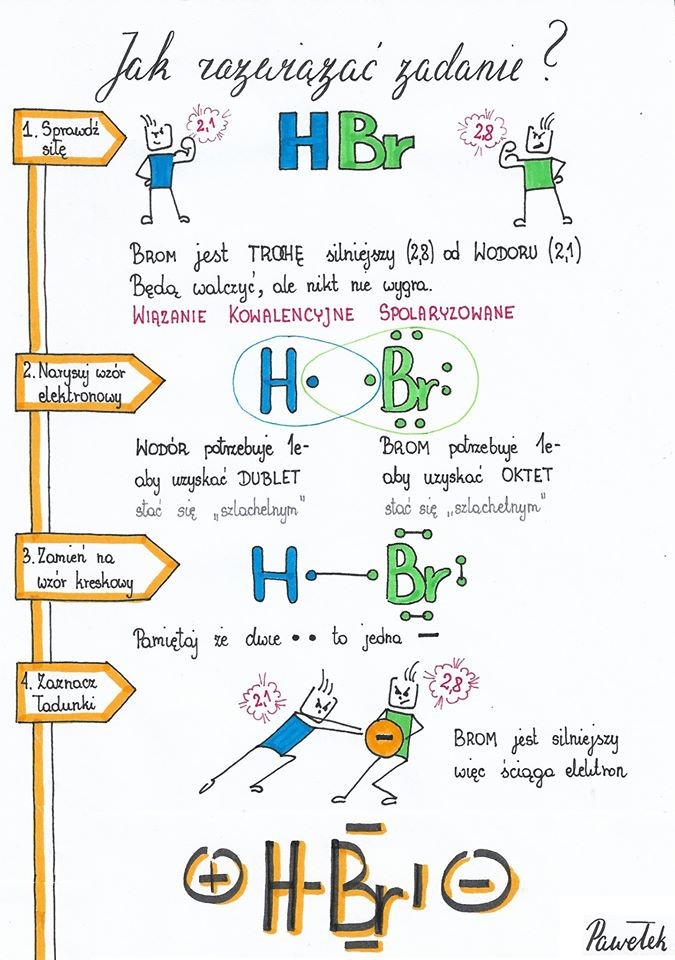
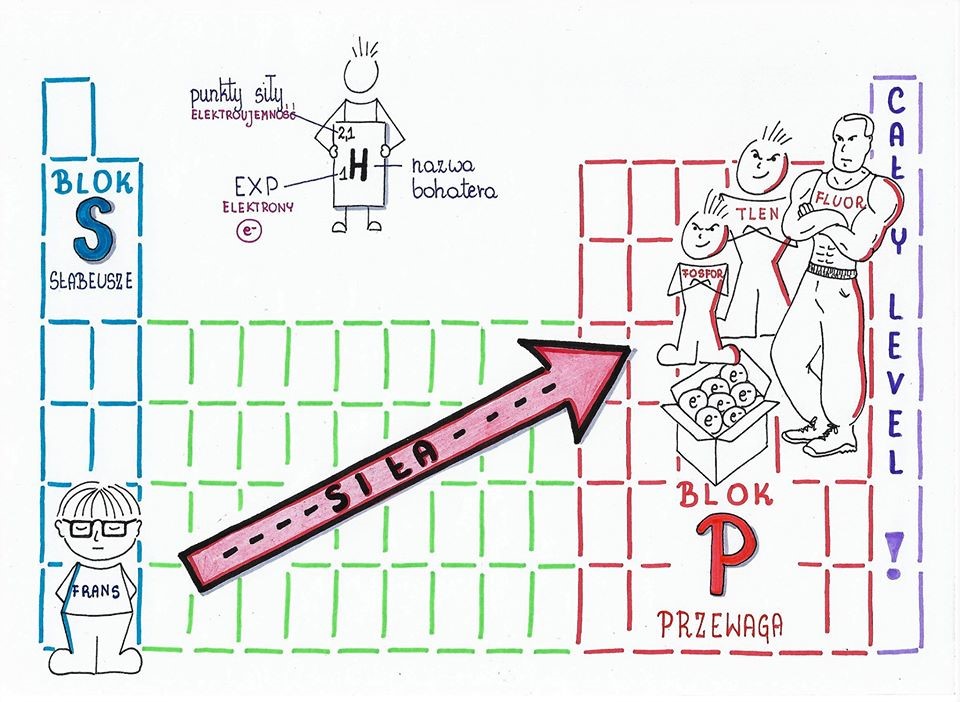
- Elektroujemność jest to zdolność atomu danego pierwiastka chemicznego do przyciągania elektronów tworzących wiązania chemiczne. Podaje się ją w liczbach od 0,7-4,0. Niską elektroujemność mają pierwiastki metaliczne ( słabeusze), a wysoką ? niemetale ( siłacze).
- Atomy pierwiastków o najmniejszej elektroujemności najsłabiej przyciągają elektrony i łatwo oddają je innym atomom .
- Atomy pierwiastków o najwyższej elektroujemności ( niemetal ? fluor) najsilniej przyciągają elektrony. Wiązanie jonowe tworzą się między metalami i niemetalami. Atomy metali oddają elektrony atomom niemetali i stają się jonami dodatnimi- kationami. Atomy niemetali przyjmują elektrony i stają się ujemnymi anionami. Kationy i aniony przyciągają się tworząc wiązanie jonowe.
Jon to cząsteczka z ładunkiem dodatnim lub ujemnym
W wiązaniu kowalencyjnym różnica elektroujemności pierwiastków tworzących wiązanie jest mniejsza niż 1,7
W wiązaniu jonowym różnica elektroujemności pierwiastków tworzących wiązanie jest większa niż 1,7
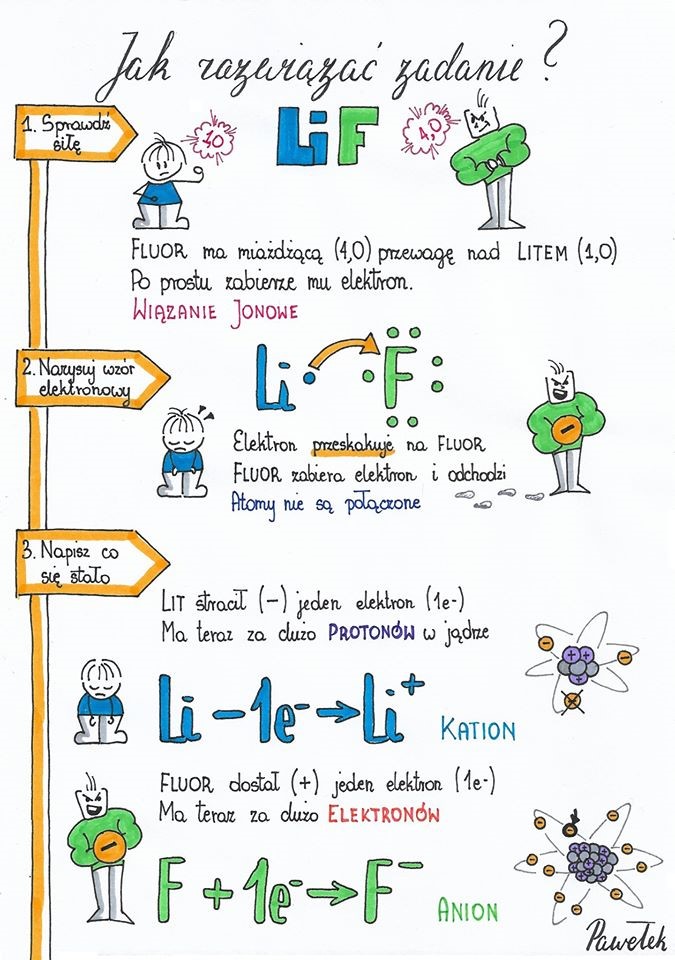
- Wiązanie jonowe tworzą się między metalami i niemetalami. Atomy metali oddają elektrony atomom niemetali i stają się jonami dodatnimi- kationami. Atomy niemetali przyjmują elektrony i stają się ujemnymi anionami. Kationy i aniony przyciągają się tworząc wiązanie jonowe.
Jon to cząsteczka z ładunkiem dodatnim lub ujemnym
Klasa 7 chemia 24.04.2020
Karta Pracy
Zadania – Wiązania chemiczne do zeszytu proszę zrobić
- Wybierz poprawną odpowiedź:
- Wiązania kowalencyjne polegają na :
? uwspólnianiu elektronów walencyjnych
– oddawaniu elektronów walencyjnych atomom pierwiastków o większej elektroujemności
- Wiązania jonowe polegają na:
– uwspólnianiu elektronów walencyjnych
– oddawanie elektronów walencyjnych atomom pierwiastków o większej elektroujemności
- Oblicz na podstawie elektroujemności pierwiastków, czy ich atomy tworzą wiązania kowalencyjne czy jonowe:
- H2 H= 2,1 2,1-2,1= 0 0 jest mniejsze od 1.7, więc jest to w cząsteczce wodoru wiązanie kowalencyjne
- HCl H= 2,1 Cl= 3,0 ??..???????????????????
??????????????????????????????????????????
c) CO C= ???? O= ?????., ???????????????????
??????????????????????????????????????????????.
- NaCl Na=????. Cl= ?????., ???????????????????..
- ?????????????????????????????????????????
- Narysuj schemat wiązania kowalencyjnego w cząsteczce wodoru :
17.04.2020
Temat: Układ okresowy pierwiastków.
- Każdy pierwiastek w układzie okresowym ma swoją ,,krateczkę?, gdzie można odczytać:

2. Wśród pierwiastków chemicznych wyróżniamy:
A) Metale np. żelazo, złoto, srebro
B) Niemetale np. azot, węgiel, tlen
3. Układ okresowy pierwiastków składa się z:
A) 18 kolumn
B) 7 okresów
4. W grupach znajdują się pierwiastki o podobnych właściwościach.
5. Każda grupa główna ma swoją nazwę.
6. Pierwiastki są ułożone w układzie okresowym według wzrastającej liczby atomowej (Z)
7. Znając numer grupy i okresu wiemy gdzie on leży w układzie okresowym pierwiastków
8. Numer okresu mówi nam o ilości powłok elektronowych ( czyli dróg po których poruszają się elektrony)
9. Numer grupy mówi nam o ilości elektronów walencyjnych , czyli tych które znajdują się najdalej jądra atomu.
Więcej informacji znajdziecie w podręczniku : str. 95-99
Dalej macie dwie karty pracy na ten tydzień do pobrania. Razem będziemy je rozwiązywać przez Messenger.
Temat: Powłoki elektronowe , izotopy
Temat: Budowa atomu – nukleony, elektony
oglądajcie proszę lekcje chemii:
klasa 7 lekcje chemii ma w poniedziałki i środy dostępne o godzinie 9.30 i powtórki o 14.00 na TVP SPORT
